Scene 1 (0s)
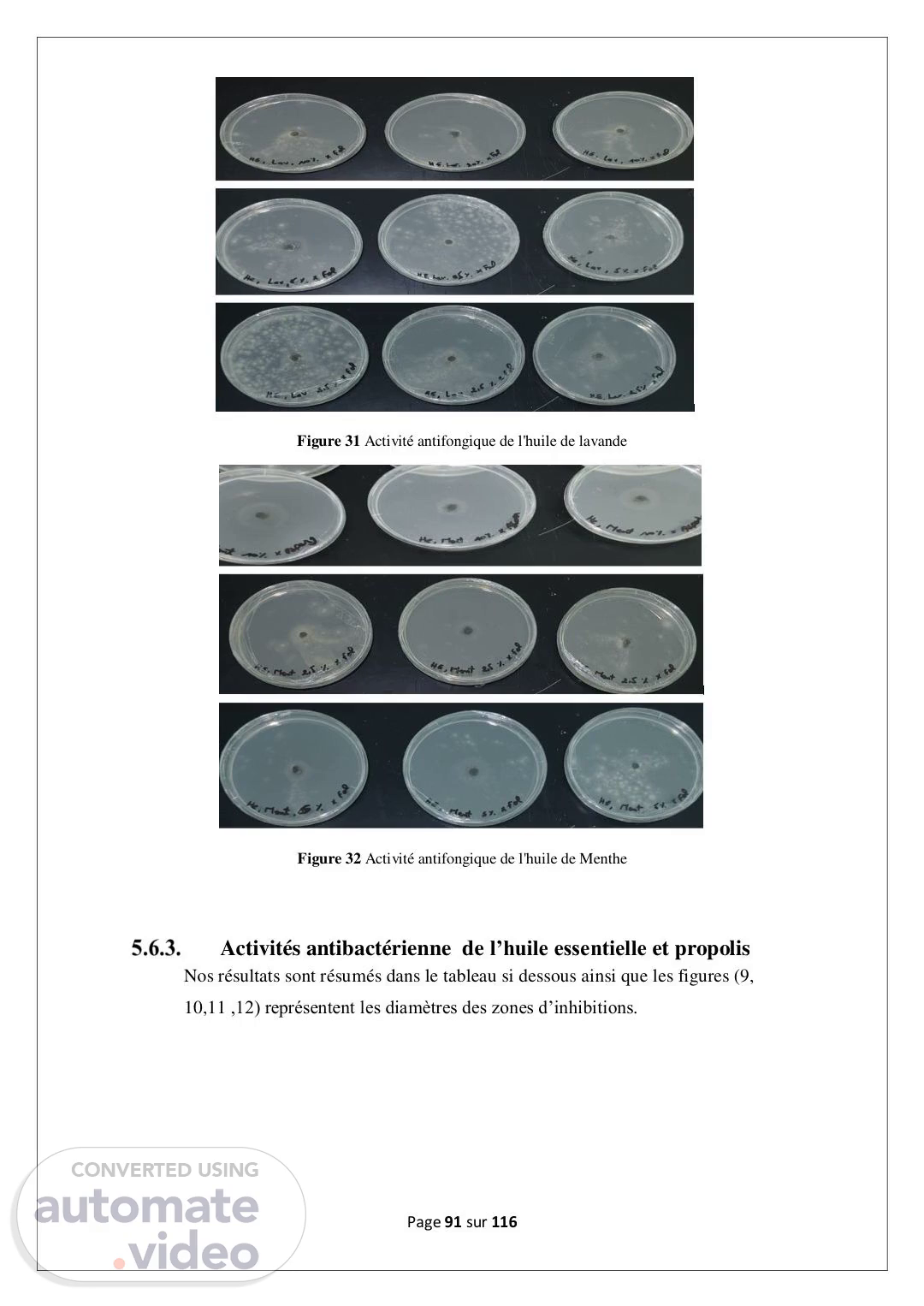
Page 91 sur 116 Figure 31 Activité antifongique de l'huile de lavande Figure 32 Activité antifongique de l'huile de Menthe Activités antibactérienne de l’huile essentielle et propolis Nos résultats sont résumés dans le tableau si dessous ainsi que les figures (9, 10,11 ,12) représentent les diamètres des zones d’inhibitions..
Scene 2 (16s)
Page 92 sur 116 Figure 33 Activité antibactérienne de l'huile du Menthe Figure 34 Activité antibactérienne de l’huile de la lavande.
Scene 3 (27s)
Page 93 sur 116 Figure 35 Activité antibactérienne de la propolis Figure 36 Activité antibactérienne de l'huile de la solution bioactif Tableau 9 Diamètres des zones d’inhibition (en mm) des bactéries testées Échantillon Concentration E-Coli SA Lavande SM 17 16 0 ,5 % 20 14 0 ,25 % 22 17 Propolis SM / / 0 ,5 % 10 20 0 ,25 % 14 20.
Scene 4 (46s)
Page 94 sur 116 Menthe SM 17 19 0 ,5 % 15 18 0 ,25 % 18 20 Solution actif 0 ,5 % / / 0 ,25 % 16 25 Témoin + Témoin - 5.7. Caractérisation du chitosane et nanoparticules Résultats du test de solubilité Le chitosane ne se dissout pas dans l’eau distillée en raison de sa structure cristalline et de la nature hydrophobe de certains de ses groupements fonctionnels ni dans des solvants alcalins concentrés ou dilués (Y.W.Ch., 2000) parce que Les conditions basiques provoquent une dé- protonation des groupes amines et Cette insolubilité est due à la masse moléculaire élevée de chaque chaîne de polymères, ainsi qu’à la formation de liaisons. Les groupes fonctionnels portés par chaque unité contiennent de l'hydrogène, mais il est soluble dans l’acide grâce à la pro- tonation de ses fonctions aminées. Son meilleur solvant est l'acide acétique. Tableau 10 Résultat de test de solubilité du chitosane synthétisé et commerciale Résultats de caractérisation par spectroscopie UV-VIS Chitosane Pour une meilleure compréhension de l'effet de la concentration sur les caractéris- tiques optiques et fonctionnelles du chitosane, des spectres d'absorbance ont été mesurés pour Solution Chitosane syn- thétisé Chitosane commerciale Acide acétique Soluble Soluble Eau Insoluble Insoluble NaOH Insoluble Insoluble.
Scene 5 (1m 37s)
Page 95 sur 116 des échantillons à 4 %, 6 %, 8 % et 10 %, et comparés à un chitosane commercial de réfé- rence Figure 37 Spectre d'absorbance du chitosane synthétisé avec différentes concentration 4% 6% 8%10% Dans le graphique du chitosane extrait Figure 37, les pics d'absorbance sont répartis autour de longueurs d'onde proches, allant de 268 nm à 280 nm selon la concentration (10 %, Figure 38 Spectre d'absorbance du chitosane commercial.
Scene 6 (1m 59s)
Page 96 sur 116 8 %, 6 % et 4 %). Cette petite variation dans les longueurs d'onde maximales pourrait être due à des différences de structure moléculaire ou de pureté, en fonction de la concentration et de la méthode d'extraction Le chitosane commercial Figure 38 présente un pic d'absorbance unique et plus stable autour de 270 nm. L’absorbance maximale varie légèrement selon la concentration. Par exemple, à 10 %, l'ab- sorbance est de 1,578, tandis qu'à 4 %, elle descend à 1,407. Cette augmentation progressive de l'absorbance avec la concentration reflète une relation linéaire. L'absorbance maximale du chitosane commercial est d'environ 1,6, ce qui est proche de l'ab- sorbance observée pour le chitosane extrait à 10 % Nanoparticules d’argent En général, on utilise la spectroscopie UV-Vis afin de mesurer la taille et la stabilité des na- noparticules fabriquées. Plusieurs recherches ont montré que le maximum d'absorption SPR des nanoparticules métalliques se trouve entre 200 et 800 nm, et il se situe généralement entre 400 et 450 nm pour l'argent. (Rónavári, 2021) Dans notre spectre figure30, on observe un pic d'absorbance distinct et intense autour de 450 nm De plus, l'intensité maximale de l'absorbance, qui atteint environ 1,2, suggère une concen- tration élevée et stable de nanoparticules La présence d'un pic net et bien défini dans notre spectre, sans décalage vers les longueurs d'onde plus élevées, laisse entendre que les nanopar- ticules sont plutôt petites, D’après (Sharma, 2009) les nanoparticules d’argent probablement dans une plage de taille inférieure à 100 nm, sphériques et bien dispersées affichent un pic proche de cette région un changement vers des longueurs d'onde plus élevées aurait pu suggé- rer une augmentation de la taille des particules ou une agrégation.
Scene 7 (3m 4s)
Page 97 sur 116 Résultats de caractérisation par la spectroscopie infrarouge à transformée de Fourier FTIR Chitosane extrait et commercial L'étude des spectres d'absorption IR permet d'obtenir une vision des différentes formes de liaisons présentes dans l'échantillon et pour déterminer le degré d’acétylation Figure 39 Spectre UV VIS de nanoparticules d'argent.
Scene 8 (3m 22s)
Page 98 sur 116 Figure 40 spectres infrarouge du chitosane extrait a partir du carapace de crevette avec deux concentration différentes de NaOH 4% 6%.
Scene 9 (3m 40s)
Page 99 sur 116 Figure 41 spectres infrarouge du chitosane extrait a partir du carapace de crevette avec deux concentration différentes de NaOH 8% 10%.
Scene 10 (3m 56s)
Page 100 sur 116 Figure 42 Spectre infrarouge d'un chitosane commercial.
Scene 11 (4m 7s)
Page 101 sur 116 Degré de désacétylation (DDA) du chitosane DDA= (1 − 𝑨𝟑𝟒𝟓𝟎 𝑨𝟏𝟔𝟓𝟓×𝐊 ) ×100 Equation 2 Degré de désacétylation A1655 est l'aire sous le pic des groupes C=O est associé aux résidus acétyles A3450 est l'aire sous le pic des groupes O-H/N-H représente les groupes hydroxyle et amine. K est une constante spécifique au chitosane, généralement autour de 115 97,59% des groupes acétyles ont été retirés pour chitosane 4% 97,8% des groupes acétyles ont été retirés pour chitosane 6% 98,20% des groupes acétyles ont été retirés pour chitosane 8% 98,33 % des groupes acétyles ont été retirés pour chitosane 10% Un DDA élevé (> 85%) est souvent préféré car il améliore la biocompatibilité, biodé- gradabilité et la solubilité dans les acides faibles et offre une meilleure activité antimicro- bienne (Chenjun Zhuang, 2019) Tableau 11 Résultats du degré de désacétylation (DDA) % Chitosane synthétisé le degré de dés acétylation (DDA) % 4% 97,59% 6 % 97,8% 8% 98,20% 10% 98,33 % Le (DDA) % de chitosane commercial 98 ,96 %.
Scene 12 (4m 50s)
Page 102 sur 116 Nanoparticule d’argent 5.8. Elaboration du pansement Test d’absorption Le tableau 12 montre une variation significative de la capacité d’absorption en fonction de la concentration, des composés bioactifs et de la méthode de polymérisation. Les panse- Figure 43 Spectre infrarouge du nanoparticule d'argent.
Scene 13 (5m 8s)
Page 103 sur 116 ments à 0.25% (étuvé et glycérol) ont absorbé respectivement 4ml et 3ml, indiquant que le pansement 0.25% (étuvé) a une capacité d’absorption meilleure. Les pansements à 0.5% (gly- cérol et étuvé) ont absorbé respectivement 2ml et 3ml, indiquant une absorption par rapport aux pansements à 0 .25%. La polymérisation à l’étuve pourrait permettre une distribution plus uniforme des composants bioactifs et la combinaison d’une concentration plus faible la struc- ture du pansement peut présenter des interstices plus larges et une meilleure porosité, ce qui permet à un plus grand volume de solution saline de pénétrer et d’être absorbé. Tableau 12 Résultats de test d'absorption Type de panse- ment Méthode de polymé- risation Volume ini- tial (ml) Volume final (ml) Volume ab- sorbé (ml) 0 .25% Etuvé 10 6 4 Glycérol 10 7 3 0.5% Etuvé 10 8 2 Glycérol 10 9 3 Taux d’humidité Selon le tableau 13, on constate une diminution de 25,6 % de l'eau dans le biofilm témoin. La diminution de l'humidité dans l'échantillon de biofilm chargé (32,9 %) est probablement due aux éléments bioactifs ajoutés (huiles essentielles, nanoparticules d'argent, propolis), qui semblent diminuer la capacité du biofilm à retenir l'humidité. Pour compenser cette augmentation de la perte, on a ajouté un agent hydratant la glycérine, dans le troisième échantillon. La perte en eau la plus faible est observée dans le biofilm char- gé avec de la glycérine (22,5 %), ce qui suggère que la glycérine a contribué à diminuer la perte d'humidité dans le biofilm chargé, ce qui améliore la stabilité et la résistance de cet échantillon par rapport aux autres Tableau 13 les résultats du test d'humidité Echantillons Masse initial (g ) Masse après sé- chage (g) Perte en eau (%) Biofilm témoin 0,671g 0,500g 25,6% Biofilm chargé 0,671g 0,450g 32,9%.
Scene 14 (6m 13s)
Page 104 sur 116 Biofilm chargé + glycerine 0 ,671g 0,520g 22 ,5% Test de perméabilité Afin d'assurer une cicatrisation efficace, il est important de maintenir un environnement humide, mais pas trop. L'absorption de l'humidité par le CaCl2, un agent desséchant, a été mesurée lors de ce test. Après 6 heures, la surface du bécher couverte par le biofilm témoin a absorbé 0,2 g d'eau, tandis que celle couverte par le biofilm chargé a absorbé 0,4 g d'eau comme le tableau 14 montre. Cela suggère que le biofilm chargé avec une solution bioactive a favorisé une absorp- tion accrue de vapeur d'eau. La perméabilité du biofilm chargé en solution bioactive semble être plus élevée que celle du biofilm témoin. Cela pourrait être dû à une augmentation de l'hydrophile globale du biofilm, ce qui facilite la transmission de la vapeur d'eau. D'autre part, la diminution de la perméabilité du biofilm témoin laisse entendre que le chitosane pur maintient une capacité barrière accrue. Tableau 14 Résultat du test de perméabilité des biofilms de chitosane Echantillon de bio- film Masse initiale de CaCl2 (g) Masse final de CaCl2 après 6h Augmentation de masse (g) Témoin 5g 5.2 0.2 Chargé en solution bioactive 5g 5.4 0 .4 Test d’enfouissement dans le sol Dans le tableau 15 montre la dégradation total des deux échantillons de biofilm à base de chitosane et l’absence de moisissures On peut expliquer la rapidité de dégradation par la structure polysaccharidique du chitosane qui se décompose facilement dans le sol Les biofilms ne présentent pas de moisissures cela suggère que les éléments bioactifs et le chitosane ont manifesté des capacités antimicrobiennes notable.
Scene 15 (7m 18s)
Page 105 sur 116 Tableau 15 les résultats du test d'enfouissement dans le sol Paramètre Biofilm témoin Biofilm chargé La durée du test Une semaine Masse initial (g) 2g 2g Masse final (g) 0g 0g Perte de masse (%) 100% 100% Observations visuelle -l’absence de moisissures -Biofilm entièrement intégré dans le sol Caractérisation des pansements par FTIR.
Scene 16 (7m 35s)
Page 106 sur 116 Figure 45 spectre infrarouge du pansement a base d'un textile non tissé Figure 44 spectre infrarouge du pansement a base du chitosane.
Scene 17 (7m 46s)
Page 107 sur 116 V. Conclusion et perspectives.
Scene 18 (7m 55s)
Page 108 sur 116 Conclusion et perspectives Ce projet de pansement biodégradable et bioactif a démontré des résultats prometteurs en matière de cicatrisation et de protection contre les infections. La combinaison de biopoly- mères naturels et d'extraits végétaux bioactifs confère au pansement des propriétés antimicro- biennes, anti-inflammatoires et cicatrisantes, créant ainsi un environnement favorable à la guérison tout en offrant une alternative écologique aux produits synthétiques. Les composants naturels, tels que les huiles essentielles et le chitosane, se sont révélés efficaces dans la régénération tissulaire et le contrôle bactérien, répondant aux besoins des soins de plaies chroniques et infectées. Pour optimiser cette solution, des études supplémentaires pourraient affiner les formu- lations pour accroître encore l'efficacité antimicrobienne et anti-inflammatoire. Des essais cliniques sont également nécessaires pour valider l’innocuité et l'efficacité du produit, permet- tant d'obtenir les certifications indispensables pour sa commercialisation. L'ajout de capteurs biodégradables pour surveiller des indicateurs comme le pH ou l’humidité renforcerait la pré- cision des soins, notamment pour les plaies chroniques, et des tests sur d’autres types de plaies (comme les brûlures et les ulcères diabétiques) ouvriraient la voie à de nouvelles appli- cations. En somme, ce pansement bioactif pourrait transformer les soins de plaies vers des solutions plus naturelles, durables et efficaces, offrant une alternative précieuse aux panse- ments conventionnels..
Scene 19 (8m 47s)
Page 109 sur 116 VI. Références bibliographiques.
Scene 20 (8m 55s)
Page 110 sur 116 Bibliographie Berset. (2006). Antioxydants phénoliques. Structures, propriétés, sources végétales. In Les polyphénols en agroalimentaire. Ed.Tec&Doc,lavoisier, 265-294. Bhattacharya, S. D. (2022). Chitosan-Based Wound Dressings. International Journal of Biological, 206, 400-420. Boulechfar, S. Z. (2019). Investigation of Antioxidant and Anticholinesterase Potential of Essential Oil and Methanolic Extract of Propolis from Mila Region. Journal of Biologically Active products from nature , 434-444. Chaloupka, K. M. (2010). Nanosilver as a new generation of nanoproduct in biomedical applications. Récupéré sur doi:10.1016/j.tibtech.2010.07.006. Fatinathan, N. a. (2008). adsorption of cu (II) ions in aqueous solution using chitosan beads, chitosan- GLA beads and chitosan-alginate beads. Chemical engineering journal, 143, 62, 72. Ferhoum, F. A. (2010). Analyse physico chimique de la propolis locale selon les étages bioclimatiques et les deux races d’abeille locale (Apis mellifica intermissa et Apis mellifica sahariensis). Sciences de l'ingénieur , 22. Flórez, P. C. (2023). "Selected Biopolymers’ Processing and Their Applications. Polymers vol.15, 641. González, M. S., & al. (2023). Zinc Oxide Nanoparticles for Wound. Healthcare Materials . Griffiths, P. R. (2007). Fourier Transform Infrared Spectrometry. John Wiley & Sons. Gutiérrez, T. J. (2023). Nanoparticles in Biopolymer-Based Wound. Journal of Nanomaterials, 54-78. Iravani, S. K. (2019). Plant-mediated synthesis of metallic nanoparticles: A review on the process and their applications. Nanomaterials . Kadouche S, F. M. (2016). lowcost chitosane biopolymer for environmental Use made from abundant shrimp wastes . waste and biomass valorization , 401-406. Kumar, A. .. (2021 ). Green synthesis of nanoparticles: An eco-friendly approach to nanoparticle synthesis with a focus on sustainability and reduced toxicity. Laboratoire Aldismed . ( (2024)). Compresse stériles en tissu non tissé (DT/FT-1402). El Eulma, Sétif: Document interne, Laboratoire Aldismed. Lee, S. K. (2020). Synthesis and stabilization of metallic nanoparticles using chemical reduction methods. Journal of Nanomaterials. Li, Y. Z., & al. (2023). Conductive Polymers in Wound Healing. Polypyrrole and Polyaniline. Advanced Materials,. Llanos, C. R., & al. (2021). Effect of drying temperature on the properties of chitosan-coated cotton fabrics. Materials Science and Engineering. MEYER-WARNOD. (1984). Natural essential oïl : extraction processes and applications to some major oils, Perfumer et Flavorist. 93-103..
Scene 21 (10m 0s)
Page 111 sur 116 Michael Oduor-odoteP, M. H. (2005). Characterization of Chitosan from blowfly larvae and some crustacean species from kenayn marine waters prepared under differen conditions . Wastern Indian Ocean J.Mar.Sci , 99-107. Rinaudo. (2006). Chitin and chitosan: Properties and applications. Progress in Polymer Science (Oxford), 603-632. RIVERA, L. L. (2006). Etude de l’extraction de métabolites secondaires de différentes matières végétales en réacteur chauffe par induction thermomagnétique directe. TOULOUSE ,FRANCE , L'institut national polytechnique . Skaugrud., O. E. (1990). Metal recovery using chitosan. Journal of Chemical Technology and Biotechnology, 395-404. Smith, B. C. (2011). Fundamentals of Fourier Transform Infrared Spectroscopy. CRC Press. Stuart, B. (2004). Infrared Spectroscopy: Fundamentals and Applications..
Scene 22 (10m 37s)
Page 112 sur 116 VII. Annexes.
Scene 23 (10m 45s)
Page 113 sur 116 1. Annexe 1 : préparation des produits chimiques et des réactifs Préparation de la solution méthanolique de DPPH : Dissoudre 4 mg de DPPH dans 100 Ml de méthanol. L’absorbance de la solution ainsi obtenue est ajustée par le méthanol à (0.80 ± 0.02) à λ= 517 nm avant l’usage. Préparation de la solution d’acide ascorbique (la référence) : Une solution méthanolique de l’acide ascorbique est préparée en dissolvant 0.5 mg de ce produit dans 100 mL de méthanol. Dilutions des colorants : Le fixateur : May-Grunwald doit être utilisé sans dilution. Le Giemsa est dilué à 1/10ème : -10ml de Giemsa -10ml de méthanol -80ml d'eau distillée Préparation de BSA : En mettant 0,2g de BSA dans 100ml de tampon TrisHCl.
Scene 24 (11m 18s)
Page 114 sur 116 Résumé: Face aux défis posés par la gestion des plaies, ce travail de recherche La recherche porte sur le développement d’un pansement innovant, biodégradable et bioactif pour la ges- tion des plaies. L’objectif principal est de créer un dispositif médical qui accélère la cicatrisa- tion tout en minimisant l’impact environnemental. Le pansement est fabriqué à partir d’extrait de chitosane provenant de carapaces de crevettes, un matériau biodégradable, et d’extraits végétaux d’huiles essentielles comme la lavande, la menthe, l’origan et la propolis. Le pan- sement possède d’excellentes propriétés de biodégradabilité, une activité antimicrobienne importante contre un large éventail de bactéries et une capacité d’absorption élevée. L’incorporation d’extraits de plantes améliore également les propriétés anti-inflammatoires et favorise la prolifération cellulaire, accélérant le processus de cicatrisation. L’étude ouvre de nouvelles perspectives pour le développement de pansements bioactifs intelligents qui peu- vent s’adapter aux besoins spécifiques des plaies. Mots clés : Pansement bioactif, Biodégradable, Chitosane, Huiles essentielles, Cicatrisation, Antimicrobial.
Scene 25 (12m 0s)
Page 115 sur 116 صخلملا تايدحتلل ةباجتسا للحتلل ةلباقو ةركتبم ةصلص ريوطت ىلع يثحبلا لمعلا اذه زكري ،حورجلا ةرادإ اهضرفت يتلا .يئيبلا ريثأتلا ليلقت عم ءافشلا عرسي يبط زاهج ءاشنإ وه يسيئرلا فدهلا .حورجلا ةرادلإ اًيجولويب ةطشنو يجولويبلا ةلباق ةدامو ،يربمجلا روشق نم نازوتيشلا صلختسم نم ةعونصم ةصلصلا تويزلا نم ةيتابن تاصلختسمو ،للحتلل يلاع طاشنو يويحلا للحتلل ةزاتمم صئاصخب ةصلصلا عتمتت .سيلوبوربلاو وناجيرولأاو عانعنلاو ردنفلالا لثم ةيساسلأا نيسحت ىلإ اًضيأ ةيتابنلا تاصلختسملا جمد يدؤي .يلاع صاصتماو ايريتكبلا نم ةعساو ةعومجم دض تابوركيملا دض لا صئاصخلا رظن تاهجو ةساردلا حتفت .ءافشلا ةيلمع عيرست ىلإ يدؤي امم ،يولخلا راشتنلاا زيزعتو تاباهتللال ةداضم حورجلل ةددحملا تاجايتحلاا عم اهفييكت نكمي اًيجولويب ةطشن ةيكذ تادامض ريوطتل ةديدج. ةيحاتفملا تاملكلا اًيجولويب , يجولويبلا للحتلل ةلباق ’ نازوتيشلا ’ةيساسلأا تويزل ’ ءافشلا ’ داضملتابوركيمل ةطشن ةدامض.
Scene 26 (12m 32s)
Page 116 sur 116 Abstract: Addressing the challenges of wound management, this research focuses on developing an innovative, biodegradable, and bioactive dressing for wound care. The main objective is to create a medical device that accelerates healing while minimizing environmental impact. The dressing is made from chitosan extracted from shrimp shells, a biodegradable material, and plant extracts of essential oils such as lavender, mint, oregano, and propolis. The dressing exhibits excellent biodegradability, significant antimicrobial activity against a wide range of bacteria, and a high absorption capacity. The incorporation of plant extracts also enhances anti-inflammatory properties and promotes cell proliferation, accelerating the healing process. This study opens new perspectives for the development of intelligent bioactive dressings that can adapt to the specific needs of different types of wounds. Keywords Bioactive dressing, Biodegradable, Chitosan, Essential oils ,Wound healing ,Antimicrobial.